アルカリ性と塩基性の違い|アルカリ性と塩基性
主要な相違点 - アルカリ度と塩基性
「アルカリ度」と「塩基性度」の2つの用語は非常に混乱しています。ほとんどの人は、これらの2つのパラメータに違いがあることを知っていますが、そのうちのほんのいくつかしか正しく定義できません。これらの2つの用語の間の キーの違い は、その定義で最もよく説明されています。 塩基性はpHスケールに直接依存する尺度であり、 および アルカリ度は、pHを有意な酸価に下げるために必要な酸量である。水の緩衝能力 としても知られています。言い換えれば、塩基性溶液のpH値は7-14から変化する。高いpH値を有する溶液はより塩基性である。両方ともいくつかの定義がありますが、一般的な考え方は似ています。 アルカリ度とは何ですか?
アルカリ度は水生生物にとって最も重要なパラメータの1つであり、水生生物にとって非常に重要です。アルカリ度は水域が酸および塩基を中和する能力を測定する。換言すれば、pH値をかなり安定した値に維持することは、水域の緩衝能である。重炭酸塩(HCO 99.999)、炭酸塩(CO 9 2-999)および水酸化物(OH 99.999)を含む水は良好な緩衝液である;水中でH 999 + 999イオンと結合して、水のpHを(より塩基性に)高めることができる。アルカリ度が低すぎる(緩衝能力が低い)場合、水の水に加えられる酸は、そのpHをより高い酸性値に低下させる。
Arrenhius: 塩基は、水中でOH - 999 - 999を生成するためにイオン化する種である。塩基性はイオン化するにつれて増加し、水中でOH - を与えます。 Bronsted-Lowry:プロトン(H 999 + 999)アクセプターは塩基と呼ばれる。ルイス: 電子対供与体は塩基と呼ばれる。 アルカリ度および塩基性に影響を及ぼす要因: アルカリ度:
アルカリ度はpH値に依存しない。水域は、より低い(高酸性)またはより高い(塩基性)pH値を有することができ、アルカリ性の値はより高い。アルカリ度は、岩石、土壌、塩類、特定の産業活動(石鹸や洗剤を含む廃水)などのいくつかの要因によって決まります。例えば、石灰石(CaCO 9 9 999)が有意に利用可能な領域は、よりアルカリ性の水を有することができる。塩基性:化合物の塩基性に影響を及ぼす因子は、塩基性の定義によって異なる。例えば、塩基の電子対利用可能性は、3つの要因に依存する。周期律表の同じ列の原子を考慮すると、最も電気陰性度の高い原子はより高い塩基性を有する。周期律表の1つの行を考えると、原子の大きさは電子密度が小さく、基本的ではない。共鳴構造をより多く有する分子は、局在化された負電荷よりも電子の利用可能性が低いため、基本的ではない。
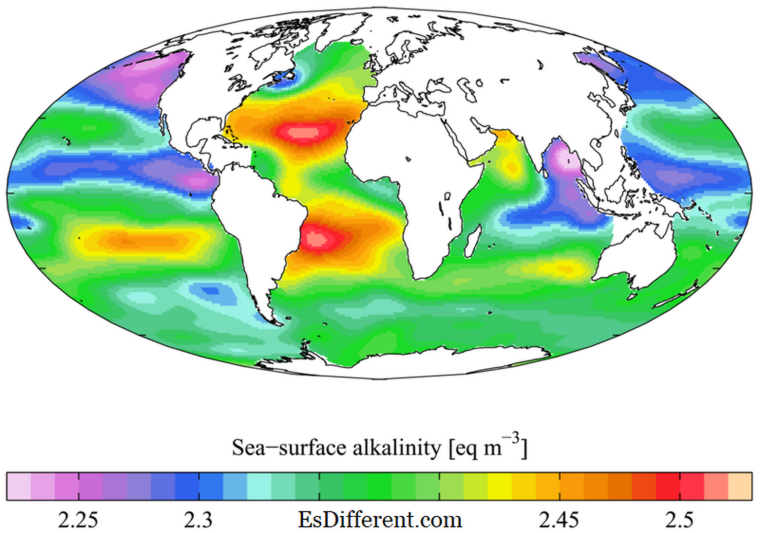
画像提供:
1。 Plumbagoによる "WOA05 GLODAP pd ALK AYool" - 自分の仕事。 [CC BY-SA 3.0] Commons
を介して2。匿名者による "Thomas Martin Lowry2" - ファラデーソクによる死亡記事。 (1936)。 [Public Domain] via Commons


